Batteriewissen
Auf dieser Seite haben wir Ihnen alles Wichtige rund um das Thema Batterien zusammengefasst. Als Erstes finden Sie ein Lexikon mit allen essenziellen Begriffsdefinitionen, die uns und unseren Kunden oft begegnen. Unser Lexikon erhebt keinen Anspruch auf Vollständigkeit, sondern wir versuchen, wichtige Begriffe aus unserem Tätigkeitsumfeld zu erklären. Wir freuen uns über weitere Ideen und Anregungen. Anschließend finden Sie detaillierteres Wissen zum Thema Batterien in Form einer kurzen Zusammenfassung der Entstehungsgeschichte der Batterie.
A
AGM
Sicher, kraftvoll und langlebig!
Die neuen, leistungsstarken Batterien basieren auf AGM-Technologie (Absorbent Glass Mat). Spezielle Mikroglasfasermatten liegen dabei zwischen den Bleiplatten der Batterie und enthalten die komplette Batteriesäure. Dabei ist die Aufnahmekapazität der Glasfasermatten so abgestimmt, dass die Säure zwar vollständig im Vlies aufgenommen wird, der Sättigungsgrad des Vlieses aber nicht erreicht wird. Das verschlossene System ist mit einem Überdruckventil, dem VRLA (Valve Regulated Lead Acid), ausgestattet, um eventuelle Gase sicher abzuleiten.
Das Verfahren bietet mehrere Vorteile
Die Batterie bleibt auslaufsicher und trocken. Bei Frost kann die sich ausdehnende Flüssigkeit keinen Schaden verursachen. Durch die Verpackung der Platten in Mikroglasfasermatten gibt es zudem nahezu keine Plattenbewegung mehr, denn Vibrationen oder Erschütterungen machen der Batterie nichts aus. AGM-Batterien können daher sogar liegend verbaut und lageunabhängig betrieben werden. Durch die Säure im Vlies ist zudem der gesamte Elektrolyt gebunden, wodurch die Wartung mit dem Nachfüllen von Wasser und das Kontrollieren des Elektrolyten entfallen! Die AGM-Batterien haben durch ihre Konstruktion einen extrem niedrigen internen Widerstand – es kommt zu einer schnelleren Reaktion zwischen Säure und Plattenmaterial: Gerade in anspruchsvollen Situationen, wie beispielsweise bei Ladevorgängen in extremer Kälte, können so höhere Energiemengen passieren!
Das Aufladen von AGM-Batterien ist denkbar einfach: Ein Ladegerät für herkömmliche Autobatterien passt – spezielle Ladegeräte oder Adapter sind nicht nötig!
Akkumulator
Ein Akkumulator oder Akku ist ein wiederaufladbarer Speicher für elektrische Energie auf elektrochemischer Basis. Er kann die elektrische Energie durch Umwandlung in chemische Energie speichern und durch Rückumwandlung wieder abgeben.
Akkupack
Als Akkupack wird ein zusammengeschaltetes Paket mehrerer Akkumulatorzellen bezeichnet, welches zur praktischen Verwendung durch eine Umhüllung oder ein Gehäuse zusammengehalten und oft auch vor äußeren Einflüssen geschützt wird. Akkupacks sind entnehmbar bzw. austauschbar gestaltet und verfügen über lösbare elektrische Kontakte, oft durch Steckverbinder.
Die verwendeten Zellen sollten dabei alle zum gleichen Typ eines Herstellers gehören, also eine möglichst identische Spannung, Kapazität und Belastbarkeit aufweisen. Innerhalb eines Akkupacks können auch Blöcke aus mehreren Zellen parallel geschaltet sein und mehrere solcher Zellblöcke wiederum in Reihe.
Alkaline
Die Alkali-Mangan-Batterie, beziehungsweise Alkali-Mangan-Zelle, ist ein galvanisches Element und zählt zu den wichtigsten elektrochemischen Energiespeichern. Aufgrund höherer Kapazität, besserer Belastbarkeit und längerer Lagerfähigkeit hat sie die Zink-Kohle-Batterie aus vielen Anwendungen verdrängt. Die Alkali-Mangan-Zelle wird zu den Primärelementen, das heißt den nicht wieder aufladbaren Batterien, gezählt. Die wichtigsten Bauformen sind zylindrische Rundzellen (beispielsweise LR6 = Alkali-Mangan AA oder Mignon) und Knopfzellen
Ampere [A]
Maßeinheit für die elektrische Stromstärke
Zeichen: A
Amperestunden [Ah]
Die Amperestunde ist eine Maßeinheit für die elektrische Ladung. Sie ist ein Produkt aus der Stromstärke (gemessen in Ampere) und der Zeitdauer (in Stunden) des Stromflusses. In Amperestunden wird gewöhnlich die Elektrizitätsmenge (Kapazität) einer Batterie oder Zelle angegeben.
Die Kurzbezeichnung ist Ah.
Anode
Die Anode (positive Elektrode) ist die Gegenelektrode zur Kathode, die Elektronen abgibt und an der in flüssiger Lösung sogenannte Oxidationsvorgänge ablaufen. Hierbei werden die Anionen (negativ geladene Ionen) entladen (Elektronenverlust). Je nach Richtung des Stromflusses in Sekundärzellen kann jede der beiden Elektroden zur Anode werden. Die negative Elektrode wird dann die Anode bei Entladung.
Ausgleichsladung
Die Ausgleichsladung ist bei manchen offenen Batterietypen erforderlich, um die mit der Zeit zurückgehende Kapazitätsmenge wieder auszugleichen. Abhängig von der Batteriebauart und den Herstellervorschriften sind Ausgleichsladungen in größeren Zeitabständen (6–9 Monate) erforderlich. Die jeweiligen Spannungen und Ströme sind den Datenblättern des Batterieherstellers zu entnehmen.
B
BAE
Die Batterieanschlusseinheit ist als Schaltschrank ausgeführt, zur Aufnahme des DC-Batterieschalters und zum Anschluss der Batteriestränge.
Batterie
Die Batterie ist ein elektrochemischer Energiespeicher. Sie besteht meist aus einer Kombination von elektrochemischen Zellen, den sogenannten galvanischen Elementen. In diesen Zellen gibt es zwei, durch ionenleitende flüssige oder feste Elektrolyte, voneinander getrennte Elektroden. In Abhängigkeit des verwendeten chemischen Systems, weisen die Batteriesysteme unterschiedliche Spannungslagen und Energiedichten auf. Das verwendete Material der Elektroden bestimmt, wie hoch die Nennspannung ist. Die speicherbare Energie wiederum ist abhängig von der Beschaffenheit und der Menge des in der Batterie verwendeten Materials. Bei der Entladung wird nun die in chemischer Form gespeicherte Energie durch eine elektrochemische Reaktion in elektrische Energie umgewandelt. Wesentliche Auslegeparameter sind: die Überbrückungszeit, die Scheinleistung und der Cos.phi-Wert des Verbrauchers, der Wechselrichterwirkungsgrad, die Zwischenkreisspannung, die Entladeschluss- und die Ladespannung.
Batterietypen
Verschlossene Batterien, geschlossene Batterien, offene Batterien
Batteriekapazität
Die Nennkapazität einer Batterie ist die Kapazität, die die Batterie beim Entladen über eine festgelegte Entladedauer (Nennentladezeit tN) bei einer Nenntemperatur, Nenndichte und einem Nennstand der Elektrolyten abgeben kann, ohne dass die Entladeschlussspannung (UsN) unterschritten wird. Diese Kapazitätsangaben beziehen sich in der Regel auf eine 10- oder 20-stündige Entladung bei Bleibatterien und auf eine 5-stündige Entladung bei Nickel-Cadmium-Batterien. Beim Einsatz in USV-Anlagen ist die entnehmbare Kapazität wegen der kurzen Entladezeit wesentlich geringer als die Nennkapazität. Zur genauen Dimensionierung benötigt man daher Tabellen oder Kurven mit Angaben der Entladeleistung in Abhängigkeit von der Entladezeit. Des Weiteren muss man beachten, dass manche Batterien ihre volle Nennkapazität nach mehreren Ladezyklen entwickeln. Eine anfänglich geringere Kapazität als angegeben kennzeichnet keinesfalls eine defekte Batterie.
Batterien geschlossen/wartungsarm
Die Elektrolytflüssigkeit in den einzelnen Batteriezellen kann, über Öffnungen im Batteriegehäuse, mit destilliertem und entmineralisiertem Wasser aufgefüllt werden. Dieser Batterietyp wird häufig auch als "offen" bezeichnet.
Batterien verschlossen/wartungsfrei
Batterien mit einer Gasrekombinationsrate von mindestens 95 %, das heißt, dass während der gesamten Lebensdauer kein Nachfüllen von Wasser erforderlich ist. Die Batterien werden im Allgemeinen als "wartungsfrei" bezeichnet.
Batterieraum
Besonders für größere Batterieanlagen wird häufig ein besonderer Raum im Inneren von Gebäuden eingerichtet. In DIN VDE 0510, Teil 2, sind die Bestimmungen zur Ausstattung des Batterieraumes festgelegt. Sie legen unter anderem die Be- und Entlüftung sowie die Sicherheitsabstände zu brennbaren und funkenerzeugenden Teilen fest.
Batteriestränge parallelschalten
Beim Parallelschalten mehrerer Batterien ist darauf zu achten, dass die Verkabelung zu den einzelnen Batteriesträngen symmetrisch angeordnet ist. Am besten ist es, die Leitungslängen gleich auszuführen, um gleiche Spannungsfälle auf den Batterieladeleitungen zu erhalten. Somit ist jedenfalls sichergestellt, dass die Ladespannung an den einzelnen Strängen gleich ist und keine Batterie eine zu hohe oder zu niedrige Ladespannung erhält.
„Battery low“
Vorwarnsignal vor Erreichen der Tiefenentladungskurve. Wird von manchen USV-Anlagen als Vorwarnung über die Schnittstellen oder über die Relaiskarte ausgegeben.
Betriebsdauer einer Batterie
Eine für Batterien definierte Zeitdauer, auch als Nenngebrauchsdauer bekannt, die beschreibt, wie viel Kapazität eine Batterie trotz Kapazitätsverlust durch Lagerung und Temperatureinwirkung noch besitzt, um ihre Funktion zu erfüllen.
Bleibatterie
Ein Akkumulator, der als Elektrolyt verdünnte Schwefelsäure benötigt. Die Elektroden bestehen aus Blei.
Bleisulfat (PbSO4)
Chemische Verbindung, die an den Plus- und Minusplatten einer Bleibatterie beim Entladen der Batterie gebildet wird. Sie entsteht durch die chemische Reaktion von Schwefelsäure mit dem Bleidioxid der positiven Elektrode bzw. dem metallischen Blei der negativen Elektrode.
D
Diffusion
Diffusion bezeichnet den physikalischen Prozess, bei dem es zu einer vollständigen Vermischung zweier oder mehrerer Stoffe kommt.
E
Elektrode
Bestehend aus aktiver Masse und dem Ableiter, erfolgen in diesem leitfähigen Gebilde innerhalb der Zelle elektrochemische Reaktionen.
Elektrolyt
Als Elektrolyt bezeichnet man eine chemische Verbindung, die im festen, flüssigen oder gelösten Zustand in Ionen dissoziiert ist und die sich unter dem Einfluss eines elektrischen Feldes gerichtet bewegt.
Elektronen
Elektronen sind negativ geladene Elementarteilchen
Endpolart
Die Endpolart gibt die Art des Batterieanschlusses an.
Energie
Beschreibt die in Wattstunden ausgedrückte Arbeit, die Spannung und Kapazität zusammen ausrichten. Je mehr Energie eine Batterie besitzt und abgeben kann, desto mehr Arbeit kann damit verrichtet werden.
Entladeschlussspannung
Spannungswert, der am Ende einer Entladung an den Batteriepolen zu messen ist. Dieser Wert wird vom Batteriehersteller in Abhängigkeit der jeweiligen Batterie angegeben. Ein Unterschreiten der Entladeschlussspannung kann zur Zerstörung der Batterie führen. Auch ist die Entladeschlussspannung abhängig von der verwendeten Belastung an der Batterie. Bei einer sehr kleinen Belastung der Batterie sind in der Regel höhere Entladeschlussspannungen einzuhalten, da sonst die Batterie geschädigt werden kann.
Erhaltungsladung
Die erforderliche Spannung, um Batterien im vollgeladenen Zustand zu halten, nennt man Erhaltungsladung. Standardwerte liegen bei 20 °C: Bleibatterien 2,23 – 2,27 V 1% je Zelle; NiCd-Batterie 1,40 V je Zelle. Die Werte der Hersteller sind absolut zu befolgen. Herrschen dauernd oder vorwiegend vom Standardwert abweichende Temperaturen am Aufstellort der Batterie vor, so sollten die o. a. Werte zugunsten einer optimalen Batterielebensdauer gemäß den Herstellerangaben angepasst werden.
ETN-Typ-Nummern
Schlüsselzahlen für Standard-Blei-(Starter-)Batterien (Akkumulatoren)
Es gibt eine "Europäische Typ-Nummer", die als Nachfolger der DIN-Typreihen heute (fast) überall angewandt wird und deren Zahlencode alle wichtigen Daten (Spannung, Kapazität, Baugruppe und Kaltstartstrom) enthält. So setzt sich die ETN-Nummer aus 3 Zahlengruppen zu je 3 Ziffern zusammen, die folgende Aussagen beinhalten:
ETN 536 046 030;
- Die 1. Zahlengruppe "5 3 6" = Gruppe A:
- Die 1. Stelle zeigt die Spannung, hierbei sind die Ziffern 1– 4 für 6-Volt-Batterien reserviert
- 5 für 12-Volt-Batterien unter 100 Ah
- 6 für 12-Volt-Batterien über 100 Ah
- 7 für 12-Volt-Batterien über 200 Ah
- 8 für Starter-Sonderbatterien
- 9 für Antriebs-, Licht- u. Solarbatterien
- Die 1. Stelle zeigt die Spannung, hierbei sind die Ziffern 1– 4 für 6-Volt-Batterien reserviert
- Die 2. und 3. Stelle zeigen die Kapazität der Batterie in Ah, daraus folgt:
- 5 3 6 = 12-Volt-Batterie mit einer Kapazität von 36 Ah (unter 100 Ah)
- 6 3 6 ist demnach eine 12-Volt-Batterie mit 136 Ah (über 100 Ah)
- 7 3 6 entspricht einer 12-Volt-Batterie mit 236 Ah (über 200 Ah)
- 7 für 12-Volt-Batterien über 200 Ah
- 8 für Starter-Sonderbatterien
- 9 für Antriebs-, Licht- u. Solarbatterien
- Die 2. Zahlengruppe "0 4 6" = Gruppe B:
Diese Zahlengruppe gibt Auskunft über die Abmessungen und Besonderheiten (Form des Unterkastens, Kastendeckel, Bodenleisten etc.) - Die 3. Zahlengruppe "0 3 0" = Gruppe C:
Mit diesen 3 Ziffern wird der Kälteprüfstrom × 10 angegeben; Beispiel: 030 × 10 = 300 A, 115 = 1150 A.
Die bisherigen DIN-Typnummern, z. B. 5 36 46, sind zu obigen Erläuterungen analog anzuwenden, hier fehlt jedoch die Aussage zum Kälteprüfstrom. Im normalen Sprachgebrauch wird jedoch meist offen nach einer "Batterie, 12 Volt – 36 Ah", bzw. " Batterie, 12 Volt – 88 Ah" (o. Ä.) gefragt. Hier reicht die Erkenntnis, dass es sich überwiegend um Standard-Akkumulatoren (Batterien) handelt, die aus dem normalen Handelssortiment bedient werden können.
Eurobat
Bei EUROBAT handelt es sich um eine Vereinigung zur Förderung der Interessen der speziellen europäischen Batterieindustrien. Mit 34 Mitgliedern innerhalb der EU, die mehr als 85 % der Batterieindustrie in Europa umfassen, arbeitet EUROBAT daran, neue Batterielösungen und neue Formen der erneuerbaren Energiespeicherung zu entwickeln. Des Weiteren spricht sie Empfehlungen über Definitionen der technischen Batterieangaben, wie z. B. Lebensdauer, aus.
G
Gasen
Bei Überladung der Batterie kann es zur Gasung kommen, das heißt, Wasserstoff tritt aus der Batterie aus und es besteht Explosionsgefahr.
Gasungsspannung
Die Spannung, bei der der Elektrolyt einer Batterie in den gasförmigen Zustand übergeht und entweicht. Die Gasungsspannung sollte nicht zu lange anstehen, da ein erheblicher Elektrolytverlust die Folge wäre – eine Zerstörung der Batterie ist dabei nicht auszuschließen. Die Gasungsspannung beträgt in der Regel: 2,4 V/Zelle bei Bleibatterien und 1,55V/Zelle bei Nickel-Cadmium-Batterien.
Gel-Batterie
Für verschiedene elektrische Verbraucher, häufige Entladungszyklen und sicheres Startvermögen bei allen Witterungsbedingungen braucht z. B. ein Motorrad eine Gelbatterie. Beim Fahren auf unbefestigtem Grund entstehen starke Vibrationen. Sportliche Kurvenfahrt, Batterieeinbau in verschiedenen Positionen, Saisonbetrieb mit längeren Stillstandzeiten und unregelmäßige Wiederaufladung: Bei all diesen Bedingungen benötigen Sie eine Batterie mit der speziellen GEL-Technologie.
Die neueste GEL-Technologie bietet durch den in Gel gebundenen Elektrolyten, außerordentliche Rüttelfestigkeit. Dabei sind die Elektroden fest in einem Multikomponentengel gelagert. Die gesamte flüssige Säure ist im Gel gebunden. Dies garantiert exzellente Zyklenfestigkeit bei verschiedensten Entladungssituationen und dazu den besten Auslaufschutz. Ein internes Gasrekombinationsverfahren schützt vor Gasentwicklung und ermöglicht das Versiegeln der Batterie. Ein druckreguliertes Ventil garantiert höchste Sicherheit sogar bei Überladung.
Gleichstrom
Als Gleichstrom wird ein elektrischer Strom bezeichnet, dessen Stärke und Richtung sich zeitlich nicht ändert (z. B. Strom aus einer elektrochemischen Stromquelle).
GroE-Batterien
GroE steht für Großoberflächen-Elektrode: Die GroE-Batterien sind geschlossene, stationäre Bleibatterien mit flüssigem Elektrolyten (verdünnte Schwefelsäure). GroE-Batterien zeichnen sich durch den besonderen Aufbau als komplett gegossene Platten mit Lamellenstruktur aus. Durch die Reinbleitechnologie, die hohe Elektrodenstärke und die niedrige Säuredichte von 1,22 kg/l ergibt sich eine exzellente Gebrauchsdauererwartung von mindestens 20 Jahren.
GroE-Batterien werden in einem Kapazitätsbereich von 75 Ah bis zu 2600 Ah gefertigt. Die positive Elektrode ist als Großoberflächenplatte ausgeführt. Der Elektrolyt ist in flüssiger Form vorhanden und muss während der Gebrauchsdauer kontrolliert werden.
Die Zyklenzahl liegt über 200. Die Batterien der GroE-Reihe zeichnen sich durch höchste Zuverlässigkeit und außergewöhnliche Betriebssicherheit aus. Hohes Spannungsniveau bei Hochstromentladung und weitgehend hohe Konstanz der elektrischen Eigenschaften über die Gebrauchsdauer hinaus sind weitere Merkmale dieser Batterie.
Die GroE wird seit mehr als 100 Jahren eingesetzt und ist somit eine der ausgereiftesten und sichersten Batterien unter allen Batteriesystemen.
GRS (Stiftung Gemeinsames Rücknahmesystem)
Diese Stiftung regelt bundesweit die fachgerechte Beseitigung verbrauchter Gerätebatterien. Ob gewerblicher Endverbraucher oder öffentlich-rechtlicher Entsorgungsträger: Die Serviceleistungen der GRS umfassen die Abholung, Sortierung und Verwertung alter Batterien.
H
Hochstromentladung
Entladung mit einer Stromstärke über 5 C.
Hochstromladung
Ladung mit einer Stromstärke gleich oder über 1 C.
I
Industriebatterie
Speicherbatterien, die ausschließlich für den industriellen, gewerblichen und landwirtschaftlichen Einsatz (z.B. für Gabelstapler, Hybridfahrzeuge) verwendet werden.
Innerer Widerstand
Ohmscher Widerstand einer Batterie
I/U Kennlinie
Die I/U – Kennline ist eine schonende Lademethode für Batterien. Zunächst wird mit konstantem Strom geladen, bis die Erhalteladespannung erreicht ist. Danach wird mit konstanter Spannung weiter geladen.
K
Kapazität
Die Kapazität gibt die verfügbare Menge an Speicher- oder Abgabemöglichkeiten einer Batterie oder Zelle (gemessen in Amperestunden) an. Batterietemperatur und Entladestrom spielen bei der Ermittlung der Kapazität ebenfalls eine Rolle und müssen zwingend mit angegeben werden (z. B. Kaltstartkapazität in Sekunden bei Kälteprüfstrom und -18 °C).
Kapazität, Nenn-
Hier wird die Kapazität beschrieben, die nach Standardbedingungen und charakteristisch bestimmt wird (z. B. 20-stündige Kapazität in Ah, Reservekapazität bei Endladung mit 25 A in Min.).
Kapazität, Rest-
Capacity, residual. Die bei Entladung mit Nennstrom aus einer Batterie mit unbestimmtem Ladezustand (z. B. nach längerer Standzeit) entnehmbare Kapazität.
Kathode
Die negative Elektrode, bei der in flüssiger Lösung Reduktionsvorgänge stattfinden, das heißt, die Kationen (positiv geladene Ionen) werden abgeschieden (Elektronengewinn). In Sekundärzellen kann jede der beiden Elektroden zur Kathode werden, je nach der Richtung des Stromflusses. Die positive Elektrode ist bei Entladung die Kathode.
Knallgas
Knallgas entsteht durch Überladung der Batterie. Hierbei findet eine chemische Reaktion statt, bei der aus dem Elektrolyten ein Gemisch aus Wasserstoff und Sauerstoff entsteht, das hochexplosiv ist.
Konstantstromtabellen
In den Konstantstromtabellen der Hersteller wird angegeben, bei welcher max. Entladeschlussspannung die Batterie einen konstanten Strom pro Zelle (oder pro Block) in Abhängigkeit der Zeit abgeben kann.
Kurzschlussstrom
Gleichstrom, der bei Kurzschluss über die Anschlusspole der Batterie fließt und nur vom Innenwiderstand der Batterie begrenzt wird. Die Kurzschlussströme sind nicht zu unterschätzen und können bei großen Akkumulatoren mehrere tausend Ampere betragen (Beispiel: Ein Akku 65 Ah kann einen Kurzschlussstrom von bis zu 1500 A abgeben). Ein Kurzschluss ist immer mit Verbrennungen oder Brandgefahr für Gegenstände verbunden. Ein vollkommener Kurzschluss an den Batteriepolen kann zu einer Explosion der Batterie führen. Aus diesem Grund muss jeder Akkumulator mit einer geeigneten Sicherung ausgestattet sein.
L
Ladeerhaltungsspannung
Die Ladespannung wird zwischen 2,26 V/Zelle und 2,29 V/Zelle eingestellt, je nach Art der Batterie. Diese konstante Spannung liegt an, um die Selbstentladung der Batterie auszugleichen.
Ladefaktor
Als Ladefaktor bezeichnet man das Verhältnis der entnommenen zur einzuladenden Batteriekapazität. Aufgrund des Wirkungsgrades muss bei Bleibatterien ca. 20 % mehr eingeladen werden; bei NiCd-Batterien liegt der Wert bei ca. 40 %.
Ladekennlinien
Man unterscheidet bei der Batterieladung folgende Kennlinien:
- I-Kennlinie
- IU-Kennlinie
- U-Kennlinie
- W-Kennlinie
- Wa-Kennlinie
Je nach Batterietyp muss eine der vorher genannten Kennlinien zur Ladung der Batterien verwendet werden. Welche Kennlinie das ist, finden Sie in der Bedienungsanleitung des Batterieherstellers.
I-Kennlinie:
Ladung mit konstantem Strom. Die Ladespannung kann unkontrolliert steigen, wodurch es zu einem starken Anstieg der Temperatur in der Batterie kommen kann. Der Elektrolyt würde kochen, die Folge wäre ein Wasserverlust. Auch würde durch die chemische Reaktion Knallgas entstehen, sodass in der Umgebung die Gefahr einer Explosion bestünde. Dieses Ladeverfahren ist nur geeignet für kleine Ladeleistungen mit wenigen Milliampere.
IU-Kennlinie:
Die Aufladung erfolgt bei leerer Batterie mit einem konstanten Strom (I-Kennlinie). Die Ladespannung ist auf die Ladeerhaltungsspannung eingestellt. Mit steigender eingeladener Kapazität in die Batterie nimmt der Ladestrom allmählich ab, und die Ladespannung steigt bis zur eingestellten Erhaltungsladespannung an (je nach Art der Bleibatterie im Bereich zwischen 2,26 – 2,29 V/Zelle). Das Ladegerät hat jetzt auf die U-Kennlinie umgeschaltet.
U-Kennlinie:
Ladung mit konstanter Ladespannung. Wird die Starkladespannung von 2,4 V/Zelle erreicht, wird der Strom automatisch heruntergeregelt, um einen zu hohen Temperaturanstieg im Akku zu verhindern. Eine zu hohe Akkutemperatur kann zur Zerstörung des Akkus führen.
W-Kennlinie:
Die Ladung erfolgt nach einer Widerstandskennlinie (W). Mit steigender Ladespannung wird der Ladestrom heruntergeregelt. Auch hier, wie bei der U-Kennlinie, muss ein Temperaturanstieg durch zu hohen Ladestrom bei hoher Ladespannung verhindert werden.
Wa-Kennlinie:
Das Ladeverhalten entspricht der W-Kennlinie. Jedoch wird nach einer eingestellten Zeit der Ladevorgang abgeschaltet.
Ladeschlussspannung
Wenn eine Batterie komplett aufgeladen ist, ist der Ladeerhaltungsstrom der Einzige, der fließt und der Selbstentladung der Batterie entgegenwirkt. Die Ladespannung wird zwischen 2,26 V/Zelle und 2,29 V/Zelle eingestellt, je nach Art der Batterie.
Lebensdauer der Batterie
Die Lebensdauer der Batterie ist von einigen Faktoren abhängig. Insbesondere muss die Wartung gemäß der Gebrauchsanweisung durchgeführt werden, um die max. Lebensdauer der Batterie zu erreichen. Von diesen Faktoren ist die Lebensdauer direkt abhängig: Ladung der Batterie, Umgebungstemperatur, Ladezyklen, Entladetiefe.
Lithium-Ionen
Die Batteriezelle enthält sowohl in der positiven und der negativen Elektrode als auch in dem Elektrolyten Lithium-Ionen.
M
Memory-Effekt
Der Memory-Effekt beschreibt den Kapazitätsverlust einer Batterie, der sich dadurch einstellt, dass diese sich den zuletzt zugeführten Entlade-Energiebedarf merkt anstatt des eigentlichen Energiebedarfs. Sinkt die Zellspannung unter den Mindestbedarf, ist die Batterie nicht mehr nutzbar, obwohl sie weiterhin elektrische Energie liefern kann.
N
Nasse Batterien
Die herkömmlichen "nassen" Verbraucherbatterien liefern ebenso zuverlässig Strom wie die AGM-Batterien. Allerdings müssen diese Batterien gewartet werden – regelmäßige Kontrolle des Flüssigkeitsstandes und gegebenenfalls Nachfüllen mit destilliertem Wasser sind Voraussetzung für ein langes Batterie-Leben.
Nennkapazität
Die entnehmbare Kapazität einer Batterie unter den vom Hersteller festgelegten Bedingungen.
Nickel-Cadmium
Bei Nickel-Cadmium-Akkus besteht eine Elektrode aus Nickel, die andere aus Cadmium. Diese Akkus sind deutlich robuster gegenüber Tiefentladung und Überladung. Die Zellen sind zyklenfest und temperaturunabhängig. NiCd-Akkus sind weitestgehend verboten und laut Batteriegesetz nur noch in Fahrrädern, Notleuchten, Alarmsystemen und medizinischen Geräten einzusetzen.
Nickel-Metallhydrid
Nickel-Metallhydrid-Akkus bestehen aus einer positiven Elektrode aus Nickelhydroxid und einer negativen Elektrode aus Metallhydrid. NiMH-Akkus bieten im Vergleich zu NiCd-Akkus bei gleicher Spannung ungefähr die doppelte Energiedichte.
Notstrombatterie
Eine Ersatz-/Hilfsstromquelle, die ununterbrochen auf Ladungserhaltung geschaltet ist.
O
OGi-Batterie
Bei der OGi Batterie handelt es sich um eine wartungsarme, geschlossene Bleibatterie mit flüssigem Elektrolyten. Das Design Life dieser Batterien beträgt bis zu 15 Jahre bei einer Umgebungstemperatur von 20 °C. Die Erhaltungsladespannung liegt bei 2,23 – 2,3 V/Zelle bei 20 – 25 °C. Die max. Umgebungstemperatur darf -20°C bis +50°C betragen. Gefertigt werden diese Batterien aus positiven, langlebigen Gitterplatten, negativ feinkörnig pastierten Gitterplatten, mikroporösen Separatoren und Gehäusen aus einem aus stabilen, flammenhemmenden, glasklaren SAN-Material.
Diese Batterien werden als Einzelblöcke mit mehreren Zellen oder als Einzelzellen hergestellt. Je nach Ausführung sind Baugrößen von 25 Ah – 900 Ah erhältlich. Eine besondere Konstruktion der Gitterplatten als Rundgitter ermöglicht es, die Innenwiderstände der Batterie zu senken. Das hat zur Folge, dass die OGi-Batterie einen sehr hohen Strom in einer sehr kurzen Zeit abgeben kann. Die Zyklenzahl der einzelnen Ladungen/Entladungen beträgt dabei > 1000.
OPzS-Batterien
OPzS-Batterien sind geschlossene Bleibatterien mit flüssigem Elektrolyten (verdünnte Schwefelsäure). OPzS-Batterien bieten in ihrem Aufbau als Zelle mit positiven Röhrchenplatten eine extrem hohe Lebensdauer von bis zu 1500 Zyklen bei 80 % Entladetiefe. Daher eignen sich Batterien mit Röhrchenplatten optimal zum Einsatz in Bereichen mit hoher Lade- und Entladebelastung, wie zum Beispiel Solaranwendungen oder für lange Überbrückungszeiten, wie in Bereichen IT/Telekommunikation und Sicherheitsbeleuchtung. Die typische Gebrauchsdauer liegt bei etwa 20 Jahren.
Anwendungsbereiche:
- IT-Telekomanwendungen
- Sicherheitsbeleuchtung
- Solar und USV
- ZSV, BEV-Technik
- Windanlagen
Die Vorteile sind:
- hohe Lade- und Entladebelastbarkeit
- hohe Zyklenfestigkeit und Langlebigkeit
- höchste Zuverlässigkeit
- sehr geeignet für extra lange Überbrückungszeiten
OPzV-Batterien
OPzV-Batterien werden als wartungsarme, verschlossene Einzelzellen vorwiegend in Kunststoffgefäßen gefertigt. Die positive Elektrode ist als Röhrchenplatte ausgeführt. Kleinere Kapazitäten bis ca. 300 Ah sind auch als 12-V-Kompaktbatterien erhältlich. Die Gebrauchsdauer liegt typischerweise bei über 15 Jahren. Die Batterien werden bis zu einer Kapazität von 3200 Ah gefertigt. Der Elektrolyt ist in gelartiger Form vorhanden und muss während der Gebrauchsdauer nicht kontrolliert werden. Die Batterien werden vorzugsweise dort eingesetzt, wo eine Überbrückungszeit von mehr als einer halben Stunde erforderlich ist. Die Baureihe OPzV bietet, neben der hohen Gebrauchsdauer im Bereitschaftsparallelbetrieb, auch eine fast ebenso hohe Zyklenfestigkeit wie die OPzS-Batterie.
Daher eignen sich OPzV-Batterien mit Röhrchenplatten optimal zum Einsatz in Bereichen mit hoher Lade- und Entladebelastung, wie zum Beispiel Solaranwendungen, oder für lange Überbrückungszeiten, wie in Bereichen IT/Telekommunikation ,Sicherheitsbeleuchtung, USV, BEV sowie Windenergieanlagen.
Vorteile:
- Hochstromfestigkeit
- waagerechter Einbau möglich
- hohe Zyklenfestigkeit und Langlebigkeit
- minimaler Wartungsaufwand
- höchste Zuverlässigkeit
P
Parallelschaltung
Zusammenschaltung mehrerer Batterieblöcke oder Batteriestränge zur Erhöhung der Kapazität. Siehe auch Batteriestränge parallelschalten.
Pluspol
Positiver Anschlusspol an einer Zelle oder Batterie.
Polarität
Dieser Begriff beschreibt das relative Ladungs- bzw. Spannungsverhältnis (Gegensätzlichkeit) zwischen zwei Elektroden
Primärzelle
Eine Primärzelle ist eine nicht wieder aufladbare Zelle.
R
Restkapazität
Der Kapazitätsanteil, der nach einer Batterieentladung in der Batterie verbleibt. Je schneller eine Batterie entladen wird und je höher dabei der Entladestrom ist, desto höher ist die verbleibende Restkapazität in der Batterie.
Restladung
Als Restladung wird die Vollladung aus undefiniertem Ladezustand bezeichnet.
Rundzelle
Eine Rundzelle hat eine zylinderförmige Bauform und steht damit im Gegensatz zu einer prismatischen Zelle mit quaderförmiger Bauform.
S
Säuredichte
Die Säuredichte wird mit einem Säureheber gemessen und gibt Aufschluss über den Ladezustand einer Blei-Säure-Batterie. Bei einer vollgeladenen Batterie beträgt die Säuredichte 1,28 kg/l, bei einer entladenen ca. 1,1 kg/l.
Säureschichtung
Beim Aufladen einer Batterie wird eine hohe Säuredichte erzielt. Diese Säure sinkt auf den unteren Teil des Batteriegefäßes hinab. Bei wiederholtem Nachladen kommt es zu unterschiedlichen Dichteverhältnissen in der Batteriesäure: Unten besteht eine hohe Dichte, oben eine weniger hohe. Dieser Zustand darf nicht über längere Zeit aufrechterhalten bleiben, da sonst die Batterie zerstört werden kann. Namhafte Batteriehersteller bieten dazu automatische Säureumwälzeinrichtungen an, um eine gleichbleibende Dichte der Säure in der Batterie zu gewährleisten.
Sekundärbatterie
Wiederaufladbare Batterie
Selbstentladung
Beschreibt den von einem Verbraucheranschluss unabhängigen Prozess der eigenen Batterieentladung. Die Selbstentladung ist ein temperaturabhängiger, ständiger chemischer Reaktionsprozess.
Separation
Ein Separator sorgt für die Isolierung zwischen der positiven und negativen Elektrode (Kathode und Anode).
Serienschaltung
Der Minuspol einer Batterie wird mit dem Pluspol der nächsten Zelle verbunden. Die Spannung des Verbundes verdoppelt sich bei konstanter Kapazität.
Spannungssack
Bei Bleibatterien bezeichnet der Spannungssack den Spannungseinbruch im ersten Moment der Entladung. Dieser Effekt ist stark von der Höhe des zu entnehmenden Stroms abhängig. Für Hochstromentladungen sollten deshalb auch hochstromfähige Batterien verwendet werden. Besonders zu erwähnen sind hierbei die sogenannten HR-Typen.
Standby
Im Standby-Betrieb ist die Batterie durchgehend parallel zu den Verbrauchern geschaltet und wird nur dann entladen, wenn die normale Stromversorgung ausfällt und das Notstromsystem zum Einsatz kommt.
Sulfation
Im tiefentladenen Zustand einer Bleibatterie kann es durch Rekristallisation zur Bildung von grobkörnigem Bleisulfat an den Elektroden kommen. Die Reaktionsfähigkeit der Elektrodenoberfläche verringert sich, und es kann bei Erschütterungen der Batterie zu Kurzschlüssen kommen.
T
Tiefentladung
Die Tiefentladung bezeichnet den Zustand der Batterie nach vollständiger Entladung mit einem kleinen Strom durch Unterschreitung der Entladeschlussspannung. Tiefentladene AGM-Vlies-Batterien müssen nach einer Tiefentladung innerhalb von 12 Stunden wieder neu geladen werden, da ansonsten die Batterie irreparabel zerstört wird. AGM-GEL-Batterien müssen innerhalb von 5 – 7 Tagen wieder aufgeladen werden.
Traktionsbatterie
Die Traktionsbatterie ist eine Antriebsbatterie.
U
Überladung
Bei einer Batterie-Überladung ist die Ladespannung zu hoch gewählt worden. Beim Laden wird zunächst das gesamte Bleisulfat wieder in Blei und Bleidioxid umgesetzt, da aber der Ladestrom weiter fließt, wird nun auch das Blei des Gitters angegriffen. Dabei wird das Gitter größer und die Festigkeit der eingepressten Stoffe lässt nach.
Umgebungsbedingungen
Bezeichnet die Faktoren, die die Batterielebensdauer deutlich einschränken können, wenn sie, entgegen den Herstellerangaben, nicht eingehalten werden. Diese sind in der Regel: Vibration, Schock, Umgebungstemperatur, Luftfeuchtigkeit, Aufstellhöhe etc.
USV-Anlage
Die Abkürzung USV steht für unterbrechungsfreie Stromversorgung. Diese Anlagen werden bei Störungen im Stromnetz als Notschaltung eingesetzt, um unterbrechungsfreie Energie liefern zu können.
V
Volt
Die Maßeinheit für elektrische Spannung wird mit V abgekürzt. Die Einheit wurde 1897 nach dem italienischen Physiker und Mediziner Graf Alessandro Volta benannt.
W
Wartungsfreie Batterie
Eine Batterie, bei der der Elektrolyt in einem Gel oder einem Mikroglasvlies (AGM) festgelegt ist und kein destilliertes Wasser nachgefüllt werden muss. Die Batterie ist verschlossen.
Wirkungsgrad
Der Wirkungsgrad beschreibt das Verhältnis von entnommener Kapazität zur eingeladenen und liegt bei Bleiakkus bei ca. 0,85.
Z
Zelle
Eine Zelle ist die kleinste Einheit einer Batterie aus positiven und negativen Elektroden, einem Separator und dem Elektrolyten. Sie bildet den Grundbaustein einer Batterie. Die Zelle speichert die elektrische Energie, wobei die Größe der Zelle durch ihre Kapazität bestimmt wird.
Zyklenfestigkeit
Die Zyklenfestigkeit gibt an, wie oft ein Akku ge- und entladen werden kann, bevor er das Ende seiner Lebensdauerende erreicht.
Zyklus
Ein Zyklus ist ein regelmäßig wiederholter Vorgang von Batterieentladung und darauffolgender Batterieaufladung.

Die Entstehungsgeschichte der Batterie

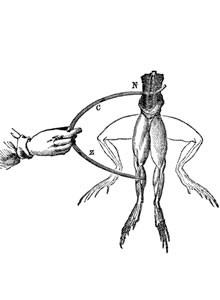

Der Beginn: Die Geschichte der elektrochemischen Energiespeicher begann mit der naturwissenschaftlichen Untersuchung der Elektrizität
Luigi Galvani (1737 – 1798), der 1789 die elektrischen Phänomene entdeckte, und Alessandro Conte di Volta (1745 – 1827), der die erste elektrische Spannungsquelle entwickelte, sind zwei Namen, die mit diesen Arbeiten verbunden sind und heute noch in den Bezeichnungen wie „galvanische Zelle“ und „Volt“ weiterleben. 1789 experimentierte Luigi Galvani, wobei ihm auffiel, dass Froschbeine zu zucken beginnen, wenn sie mit zwei verschiedenen Metallen in Berührung kommen. Er schloss daraus auf einen Zusammenhang zwischen der Elektrizität und bestimmten Muskeltätigkeiten.



Zehn Jahre später, also 1799, baute A. C. di Volta die erste einfache Batterie: Er schichtete Kupfer- und Zinkscheiben abwechselnd übereinander und legte zwischen die Scheiben jeweils ein in Salzlösung getränktes Stück Pappe. Diese „Volta‘sche Säule” lieferte Energie, wenn die Scheiben durch Draht verbunden wurden. Die Spannung ließ sich, mit mehreren Säulen in Reihe geschaltet, erhöhen.
Johann Wilhelm Ritter, der mit Goethe auf dem Gebiet der Naturwissenschaften zusammenarbeitete, baute 1802 eine Batterie, die „Ritter‘sche Säule”. Die Säule bestand aus übereinander geschichteten und mit Tafelsalz (Natriumchlorid) getränkten Kupfer- und Kartonscheiben. Diese Vorrichtung konnte mit einem elektrischen Strom geladen werden und gab bei der Entladung Strom ab. Die „Ritter’sche Säule” gilt als Urform des heutigen Akkumulators.
Etwa in den Jahren 1840 bis 1850 arbeiteten Wilhelm Josef Sinsteden und Gaston Planté mit den ersten Bleibatterien (System Blei-Schwefelsäure-Bleidioxid) und nutzten sie zur Stromspeicherung für telegrafische Experimente. Beide setzten als Elektroden Bleiplatten ein, die durch mehrfaches Laden und Entladen eine gewisse Kapazität erhielten. Für die industrielle Fertigung waren diese Batterien aber noch nicht geeignet.
Dank der Industrialisierung entwickelte sich der elektrochemische Energiespeicher zügig. Dynamo und Glühlampe waren gegen Ende des 19. Jahrhunderts erfunden. Der Bedarf, elektrische Energie zu speichern, wuchs rasch. Etwa 1880 wurde damit begonnen, Bleibatterien industriell zu produzieren, als Camille Fauré ein Patent zur Herstellung pastierter Platten für Bleiakkumulatoren anmeldete. Waldemar Jungner und Thomas Edison folgten 1899 und 1901 mit der Nickel-Cadmium-Batterie, die sehr bald auch gefertigt werden konnte.
Die Frühzeit des Bleiakkumulators
Der Physiker Fauré bedeckte beide Seiten eines Bleiblechs mit einer Paste aus Bleipulver und Schwefelsäure. Damit erreichte er schon nach der ersten Aufladung (der „Formation”) eine besonders hohe Kapazität – ein wesentlicher Durchbruch, der zur industriellen Herstellung solcher Batterien führte. So entstand eine Reihe von Betrieben, wie die S.A. La Force et la Lumière, in der William Thomson mitarbeitete. Später zum Lord Kelvin of Largs ernannt, gab er der absoluten Temperaturskala ihren Namen. Anfangs dachte man an große Stromspeicher: W. Thomson entwickelte einen Plan, der die Stadt Buffalo von den Niagara-Fällen aus mit Strom beliefern sollte. 80.000 Volt (V) Spannung sollten erzeugt und nach Buffalo in eine Batterie mit 40.000 Zellen eingespeist werden. Dort sollten die Haushalte mit Abgriffen über jeweils 50 Zellen mit 100 V Netzspannung versorgt werden. Dieser Plan wurde aber aus unterschiedlichen Gründen nicht verwirklicht.
Die Fauré-Zellen, in denen positive und negative Elektroden spiralförmig aufgewickelt waren, erwiesen sich als wenig haltbar und versagten schon nach wenigen Lade-/Entladezyklen. Dies stellte ein ernstes Hindernis für die industrielle Batterieherstellung dar.
Elektrodenformen

Eine deutliche Verbesserung brachte 1881 die Idee von J. Scudamore Sellons, die Paste nicht auf ein glattes Blech aufzutragen, sondern in ein perforiertes selbiges einzuarbeiten, um eine bessere Haftung zu erreichen. Er war der erste Metallkundler, der Antimon-Legierungen als Gittermaterial benutzte, was sich später als sehr effizient erweisen sollte. Ernest Volckmar entwickelte im gleichen Jahr ebenfalls ein Bleigitter. Es ist jedoch offen, wie weit der eine vom anderen wusste. Damit war die schon bald in vielen Varianten bekannte „Gitterplatte” erfunden.
Ebenfalls 1881 wurde von Charles F. Brush eine großflächige Bleielektrode mit gerippter Oberfläche als Patent angemeldet, der Vorläufer noch heute üblicher Großoberflächenplatten. Diese beiden Plattentypen (Gitterplatte und Großoberflächenplatte) spielen bei der Batterieherstellung immer noch eine entscheidende Rolle. Auch die entwickelte Röhrchenplatte („Panzerplatte”), die vor allem in Europa und Japan häufig für Antriebs- und stationäre Anwendungen verwendet wird, blickt auf eine lange Entwicklung zurück: S. C. Currie erfand die Grundform 1881.
Bei dieser Plattenkonstruktion liegt im Zentrum eines Röhrchens von etwa 8 mm Durchmesser ein Bleistab, der bis heute als Leiterelement benutzt wird. Die mechanische Stützung des aktiven Materials wird durch eine äußere Hülle aus gewobenem oder nicht gewobenem Stoff erreicht.
Die besondere Rolle der Legierungen im Bleiakkumulator
Stabil ist diese Situation aber nicht, vielmehr schreitet die Korrosion in der Hauptmasse des Metalls allmählich fort und wandelt Gittermaterial zu Bleidioxid um. Dadurch verliert das Gitter an mechanischer Stärke, und seine Leitfähigkeit wird vermindert. Der Korrosionsvorgang unter der Deckschicht ist aber so langsam, dass dadurch die Brauchbarkeit der Batterie bei angemessener Auslegung der Bauteile zeitlich nicht begrenzt wird.
Das Potenzial der negativen Elektrode liegt 0,35 V unter dem Gleichgewichtspotenzial der Wasserstoffelektrode. Normalerweise müsste sich Wasserstoff aus dem Wasser der verdünnten Schwefelsäure bilden und gleichzeitig die Batterie entladen. Die Wasserstoffentwicklung an Blei ist aber außerordentlich gehemmt, und das Gas bildet sich nur sehr langsam. Die „Selbstentladung” der negativen Elektrode ist unvermeidlich, geht aber derart langsam vonstatten, dass sie toleriert werden kann.
Die Geschichte der Gitterlegierungen aus reinem Blei („Feinblei”) beginnt mit der auf Planté zurückgehenden Großoberflächenplatte, bei der auf einem massiven Gusskörper eine dünne Schicht aktiven Materials durch elektrochemische Oxidation erzeugt wird. Als Material für leichtere Gitter ist Blei ohne Zusätze wenig geeignet, weil es keine ausreichende Festigkeit zur weiteren Verarbeitung hat. Des Weiteren sind Gitter oder Platten aus reinem Blei im üblichen Fertigungsprozess kaum zu handhaben.
Unter den geografischen Bedingungen der USA mit vielen entlegenen Relaisstationen bereitete dies erhebliche Probleme, weshalb in den BELL-Laboratorien intensiv nach Auswegen gesucht wurde. Die Möglichkeit, Blei-Calcium-Legierungen anstelle von Blei-Antimon-Legierungen einzusetzen, wurde ab 1935 untersucht und schließlich für ortsfeste Batterien in BELL-Anlagen 1951 spezifiziert. Trotz der ausgedehnten Vor- und Feldversuche war die Enttäuschung groß: Die erwartete Lebensdauer der Batterien wurde zunächst in vielen Fällen auch nicht annähernd erreicht.
Als Maßnahme gegen das Wachsen der Gitter wurden in den BELL-Laboratorien daraufhin feststehende Spezialbatterien mit untertassenförmigen Elektroden aus Reinblei entwickelt. Sie wurden 1970 für Telefonanlagen bei BELL eingeführt.
Entscheidend ist dabei der Zusatz von Metallen, die zu einer feinen Struktur des erstarrten Materials führen („Feinkornlegierung”) – ansonsten lassen sich solche Legierungen mit geringem Antimongehalt nicht einwandfrei gießen. Der Zusatz geringer Mengen Selen (=200 g/Tonne) erwies sich als besonders wirksam. Das Selen bildet in der geschmolzenen Legierung feine Bleiselenid-Partikel (PbSe), die bei der Erstarrung zu Kernen die Bildung zahlreicher Kristalle bewirken. So entsteht die gewünschte Struktur aus feinen Körnern.
Bleibatterien mit diesen Legierungen haben einen so geringen Wasserverlust, dass bei "Stand-by"-Anwendungen unter normalen Bedingungen ein Nachfüllen erst nach mehr als 5 Jahren erforderlich ist. Der zurückgebliebene Antimongehalt stabilisiert den Zyklusverlauf derart, dass mehr als 1000 Lade-/Entladezyklen erreicht werden können. Unter normalen Betriebsbedingungen benötigen solche Standard-Starterbatterien mit dem Prädikat „wartungsfrei nach DIN” innerhalb ihrer normalen Lebensdauer von etwa 5 Jahren kein neues Wasser.
Die Weiterentwicklung des Bleiakkumulators
Schon Ende des 19. Jahrhunderts waren der Bleiakkumulator und drei seiner noch heute üblichen Elektroden bekannt und wurden bereits gefertigt. Die Entwicklung ging in den folgenden hundert Jahren weiter. Eine genauere Kenntnis der Einflussgrößen hat verbesserte Produktionsprozesse und den Einsatz neuer synthetischer Materialien ermöglicht, die zur Herstellung von Separatoren und Gefäßen verwendet werden. Nur einige dieser Weiterentwicklungen können im Folgenden skizzenhaft beschrieben werden.
Röhrchenelektroden nutzen das aktive Material sehr gut aus und garantieren eine hohe Zyklenstabilität. Die Röhrchen bestanden anfangs aus geschlitztem Hartgummi. Nach dem Zweiten Weltkrieg wurden geflochtene Glasfasern, gewobenes Material aus Glas- und Kunststofffasern bzw. Gewebe oder Filz aus reinem Kunststoff (Polyester) als Röhrchenmaterial eingeführt.
Die ventilregulierte Blei-Säure-Batterie (VRLA)
Die ventilregulierte Blei-Säure-Batterie vermindert den Wartungsaufwand erheblich. Sie arbeitet nach dem gleichen Prinzip wie die gasdichte Nickel-Cadmium-Batterie: Der beim Überladen an der positiven Elektrode entstehende Sauerstoff verlässt die Zelle nicht, sondern wird an der negativen Elektrode wieder zu Sauerstoff-Ionen (O2) reduziert, die zusammen mit Wasserstoff-Ionen (H+) Wasser bilden. Die Entwicklung von Sauerstoff, die durch das Überladen der positiven Elektrode verursacht wird, wird also durch die Verminderung dieses Sauerstoffs an der negativen Elektrode ausgeglichen. Bei perfektem Ablauf des internen Sauerstoffkreislaufs tritt kein Wasserverlust auf.
Solch ein „perfekter interner Sauerstoffkreislauf” lässt sich bei Bleibatterien nicht realisieren, da eine gewisse Wasserstoffentwicklung an der negativen Elektrode nicht zu vermeiden ist – auch nicht bei elektrisch unbelastetem Ruhepotenzial der Zelle. Ein weiteres Hindernis stellt die unvermeidliche Gitterkorrosion an der positiven Elektrode dar. Diese beiden Nebenreaktionen mindern den Wirkungsgrad des internen Sauerstoffkreislaufs. Deshalb lässt sich ein gewisser Wasserverlust bei verschlossenen Bleibatterien nicht verhindern – ein prinzipieller Unterschied zur Nickel Cadmium-Batterie.
Um einen effektiven internen Lade-/Entladezyklus zu erreichen, muss der Sauerstoff die negative Elektrode als Gas erreichen, was bei Diffusion durch flüssigen Elektrolyten zu langsam wäre. Der wird durch das „Festlegen” des Elektrolyten erreicht: Das Elektrolyt wird entweder durch den Zusatz von Silizium-Dioxyd (SiO2) geliert, wobei sich durch Schrumpfung Risse bilden, in denen Gastransport möglich ist, oder die Säure wird in Glasvlies aus extrem feinen Glasfasern mit Durchmessern im Mikrometerbereich (µm) aufgesaugt. Der Gastransport erfolgt in absorbierenden Glasmatten durch die größeren, nicht mit Elektrolyt gefüllten Poren.
Versuche, feststehende Elektrolyten aus Gel zu entwickeln, wurden schon Ende des 19. Jahrhunderts unternommen. Wie bei „Trockenbatterien” sollte ein Verschütten der Schwefelsäure auch bei Gehäusebruch ausgeschlossen sein. Damals wurde dieser Methode für Bleibatterien noch wenig bzw. keinerlei Bedeutung beigemessen. Ein Akkuhersteller, die Firma „Sonnenschein“, griff das Verfahren Ende 1950 wieder auf, zunächst für kippsichere Kleinakkumulatoren. Diese wurden mit Ventilen ausgerüstet und hatten damit die charakteristischen Merkmale der ventilregulierten Blei-Säure-Batterie.
In den siebziger Jahren wurden Glasfasern mit Durchmessern im µm-Bereich, als Vlies strukturiert, eingeführt und sorgten für ein breites Anwendungsgebiet der ventilregulierten Blei-Säure-Batterie. Die Fähigkeit dieses ursprünglich für Feinstfilter entwickelten Materials, den schwefelsauren Elektrolyten aufzusaugen, erlaubte dessen Einsatz als Separator, der zugleich kurze Zyklen (Kurzschluss) zwischen den Elektroden verhindert und den Elektrolyten aufnimmt. Ein Vorteil solcher absorbierender Glasmatten-Separatoren ist, dass mit ihnen Batterien auf den üblichen Fertigungsanlagen hergestellt werden können. Außerdem hat der Glasmattenseparator einen so geringen Widerstand, dass der Batterie hohe Entladeströme mit gutem Wirkungsgrad entnommen werden können. Das führte Ende der siebziger Jahre zur Einführung von ventilregulierten Starterbatterien für Kraftfahrzeuge. Diese hatten jedoch am Markt keinen echten Erfolg – der Vorteil einer solchen Starterbatterie wurde aus unterschiedlichen Gründen zerredet.
Sehr erfolgreich war aber die Entwicklung einer solchen Batterie für Telefonanlagen, die den Trend auslöste, verschlossene Bleibatterien für viele ortsfeste Anwendungen einzusetzen. So werden heute Anlagen zur unterbrechungsfreien Stromversorgung überwiegend mit ventilregulierten Blei-Säure-Batterien ausgerüstet. Das geschieht nicht nur wegen des geringeren Wartungsaufwands und der niedrigen Hydrogen-Gas-Entwicklung, sondern auch wegen der Möglichkeit, diese Batterien unmittelbar neben den elektronischen Bauelementen aufzustellen, da keine Gefahr besteht, dass korrosive Dämpfe aus der Batterie austreten.
Auch die ventilregulierten Bleibatterien mit geliertem Elektrolyten (Gel) wurden weiterentwickelt. Diese Entwicklung führte ebenfalls in den siebziger Jahren dazu, das Prinzip auf größere Batterien zu übertragen. Heute werden ventilregulierte Batterien mit geliertem Elektrolyten bis zur Kapazität von 3000 Ampèrestunden (Ah) pro Zelle angeboten. Zurzeit sind verschiedene Baureihen von Gel-Batterien für stationäre und/oder mobile Anwendung am Markt. Durch den festgelegten Elektrolyten – ob nun in Glasvlies gebunden oder durch Silikate geliert – ist aus ökologischer Sicht auch eine Verbesserung für die Umwelt entstanden.
Allgemeine Weiterentwicklung
Neben den beschriebenen, speziellen Entwicklungen hat es bei allen Bleibatterien im Laufe der Jahrzehnte erhebliche Neuerungen gegeben.
Zur Trennung der Elektroden kamen zunächst Abstandhalter aus Hartgummi oder dünne Holzbrettchen zur Anwendung. Anno 1915 wurde in den USA ein poröser Separator auf Gummibasis patentiert, 1924 ein ähnlicher in Deutschland mit Latex als Ausgangsmaterial. In beiden Fällen wurde ein definiertes Porensystem aus Dehnmitteln und Füllstoffen erzielt, die werden mit gewissen Abwandlungen noch heute verwendet werden. Nach 1945 dienten verstärkt Kunststoffe als Material für Separatoren, vor allem PVC und Polyäthylen. Für Batteriegefäße wurden ebenso zunehmend Kunststoffe anstelle von Glas oder Hartgummi verwendet.
Immer perfektere elektronische Bauteile erlaubten eine verbesserte Ladetechnik. So konnte bei Kfz-Starter-Batterien der mittlere Ladezustand erhöht und die Lebensdauer verlängert werden. Ortsfeste Batterien waren besser zu überwachen, was unerwartete Ausfälle verhinderte. In den letzten Jahren hat sich dieser Trend fortgesetzt. Heute werden Geräte zur kontinuierlichen Überwachung der Batterie (Monitoring) angeboten.
Batterien für Elektro-Straßenfahrzeuge sind meist mit einem „Management-System” verbunden, das nicht nur Temperatur und Ladezustand der Batterie überwacht, sondern insbesondere auch Tiefentladung und schädliche Überladung vermeidet. Wenn nötig, werden zusätzlich einzelne Zellen oder Blöcke innerhalb der Batterie bei starker Beanspruchung automatisch geladen. Dies garantiert einen gleichmäßigen Ladezustand der Zellen einer Batterie und sichert somit eine wirtschaftliche Nutzung über die gesamte Betriebsnutzungsdauer des Akkumulators.




